一、选择题(本大题共10小题,每小题2分,共20分.每小题给出的四个选项中,只有一个最符合题意)
1.(2分)(2013•天津)我们每天生活在不断变化的物质世界里.下列变化属于化学变化的是( )
A. 瓷碗破碎 B. 石蜡熔化 C. 纸张燃烧 D. 湿衣晾干
考点: 化学变化和物理变化的判别.
专题: 物质的变化与性质.
分析: 化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.
解答: 解:A、瓷碗破碎的过程中只是形状发生改变,没有新物质生成,属于物理变化.
B、石蜡熔化过程中只是状态发生改变,没有新物质生成,属于物理变化;
C、纸张燃烧过程中生成二氧化碳等物质,属于化学变化;
D、湿衣晾干过程中只是状态发生改变,没有新物质生成,属于物理变化;
故选C.
点评: 解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化.
2.(2分)(2013•天津)地壳中含量最多的非金属元素是( )
A. Si B. Fe C. Al D. O
考点: 地壳中元素的分布与含量.
专题: 物质的微观构成与物质的宏观组成.
分析: 根据地壳中各元素含量的排序及元素的分类进行分析判断.
解答: 解:地壳含量较多的元素(前四种)按含量从高到低的排序为:氧、硅、铝、铁,其中含量最多的非金属元素是氧元素.
A、硅是非金属元素,地壳中含量最多的非金属元素是氧,不是硅,故选项错误.
B、铁是金属元素,地壳中含量最多的非金属元素是氧,不是铁,故选项错误.
C、铝是金属元素,地壳中含量最多的非金属元素是氧,不是铝,故选项错误.
D、氧是非金属元素,地壳中含量最多的非金属元素是氧,故选项正确.
故选D.
点评: 本题很简单,熟记地壳里各元素的含量、了解元素的分类是正确解答本题的关键.
3.(2分)(2013•天津)下列气体与空气混合后遇明火,可能发生爆炸的是( )
A. 甲烷 B. 氮气 C. 氧气 D. 二氧化碳
考点: 燃烧、爆炸、缓慢氧化与自燃.
专题: 化学与生活.
分析: 爆炸是指在有限的空间里,化学反应中放出大量的热,生成大量的气体从而发生爆炸,可燃性气体与氧气或空气混合遇明火可能发生爆炸.
解答: 解:A、甲烷是可燃性气体,故A可能发生爆炸;
B、氮气不是可燃性气体,不与氧气不反应,故B不可能发生爆炸;
C、氧气是助燃性的气体,与空气混合不可能发生爆炸;
D、二氧化碳不是可燃性气体,不能和氧气反应,不可能发生爆炸;
故选A.
点评: 本题主要考查了爆炸的有关知识,完成此题,可以依据爆炸的条件进行.
4.(2分)(2013•天津)厕所用清洁剂中含有盐酸,如果不慎洒到大理石地面上,会发出嘶嘶声,并有气体产生.这种气体是( )
A. 二氧化碳 B. 二氧化硫 C. 氢气 D. 氧气
考点: 酸的化学性质.
专题: 常见的酸 酸的通性.
分析: 反应前的物质是盐酸和大理石,接触后发出“嘶嘶”声,并有气体生成,由于大理石的主要成分是碳酸钙,所以此气体应该是二氧化碳.
解答: 解:大理石的主要成分是碳酸钙,遇到盐酸会生成二氧化碳从而发出嘶嘶声;
故选A.
点评: 此题是对酸的化学性质的考查,解题的关键是掌握大理石的主要成分是碳酸钙,盐酸与碳酸盐反应会生成二氧化碳.
5.(2分)(2013•天津)下列说法中正确的是( )
A. 木炭燃烧后生成黑色固体
B. 氢气在空气中燃烧,产生淡蓝色火焰
C. 红磷在空气中不能燃烧
D. 硫燃烧时生成无色无味的气体
考点: 氧气与碳、磷、硫、铁等物质的反应现象.
专题: 实验现象的观察和记录.
分析: A、根据木炭在氧气中燃烧的现象进行分析判断.
B、根据氢气在空气中燃烧的现象进行分析判断.
C、根据红磷在空气中燃烧的现象进行分析判断.
D、根据硫燃烧时的现象进行分析判断.
解答: 解:A、木炭在氧气中燃烧,发出白光,生成能使澄清石灰水变浑浊的气体,故选项说法错误.
B、氢气在空气中燃烧,产生淡蓝色火焰,故选项说法正确.
C、红磷在空气中燃烧,产生大量的白烟,故选项说法错误.
D、硫燃烧时生成,产生一种具有刺激性气味的气体,故选项说法错误.
故选B.
点评: 本题难度不大,掌握常见物质燃烧的现象即可正确解答;在描述物质燃烧的现象时,需要注意光和火焰、烟和雾的区别.
6.(2分)(2013•天津)下列几种常见的饮料中,不含有机物的可能是( )
A. 果汁 B. 矿泉水 C. 牛奶 D. 啤酒
考点: 有机物与无机物的区别.
专题: 化学与生活.
分析: 有机物是指含有碳元素的化合物.无机物是指不含有碳元素的化合物.
解答: 解:A、果汁中含有丰富的维生素,维生素属于有机物.
B、矿泉水的主要成分是水,还含有一些矿物质,一般不含有有机物.
C、牛奶中含有丰富的蛋白质,蛋白质属于有机物.
D、啤酒中含有酒精,酒精属于有机物.
故选:B.
点评: 含有碳元素的化合物中,一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,但是这些物质的性质和无机物相似,把它们归入无机物.
7.(2分)(2013•天津)高铁酸钠(Na2FeO4)是一种“绿色环保高效”的饮用水消毒剂.高铁酸钠中铁元素的化合价为( )
A. +2 B. +3 C. +5 D. +6
考点: 有关元素化合价的计算.
专题: 化学式的计算.
分析: 根据高铁酸钠的化学式为Na2FeO4,利用Na、O元素的化合价及化合物中正负化合价的代数和为0来解答.
解答: 解:在Na2FeO4中,Na元素的化合价为+1价,O元素的化合价为﹣2价,设该化合物中Fe元素的化合价为x,由化学式和化合物中正负化合价的代数和为0,则(+1)×2+x+(﹣2)×4=0,解得x=+6.
故选D.
点评: 本题考查元素化合价的计算,学生应学会利用化学式、常见元素的化合价及化合价的计算原则来解答.
8.(2分)(2013•天津)已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A. Mn+2HCl=MnCl2+H2↑ B. Mg+MnSO4=MgSO4+Mn
C. Fe+MnSO4=FeSO4+Mn D. Mn+CuSO4=MnSO4+Cu
考点: 金属活动性顺序及其应用.
专题: 金属与金属材料.
分析: 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢;在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来;据此进行分析判断.
解答: 解:A、金属锰在金属活动性顺序中位于铝和锌之间,铝、锌是氢之前的金属,则锰排在氢的前面,能和盐酸发生置换反应,故A不符合题意.
B、金属锰在金属活动性顺序中位于铝和锌之间,则镁排在锰的前面,能与MnSO4溶液发生置换反应,故B不符合题意.
C、金属锰在金属活动性顺序中位于铝和锌之间,则锰的活动性比铁强,所以不能和MnSO4溶液发生置换反应,故C符合题意.
D、金属锰在金属活动性顺序中位于铝和锌之间,锌的活动性比铜强,所以锰排在铜的前面,能和CuSO4溶液发生置换反应,故D不符合题意.
故选C.
点评: 本题难度不是很大,考查了金属活动性顺序的应用,掌握金属活动性顺序并能灵活运用是正确解答此类题的关键所在.
9.(2分)(2013•天津)现将10gA和足量B混合加热,A和B发生化学反应,10gA完全反应后生成8gC和4gD,则参加反应的A和B的质量比是( )
A. 1:1 B. 2:1 C. 4:1 D. 5:1
考点: 质量守恒定律及其应用;常见化学反应中的质量关系.
专题: 结合课本知识的信息;物质质量守恒.
分析: 由题意可知,反应物是A和B,生成物是C和D,根据质量守恒定律可以求出参加反应的B的质量,进而求出参加反应的A和B的质量比.
解答: 解:10gA完全反应后生成8gC和4gD,由质量守恒定律可知,参加反应的B的质量为2g,故参加反应的A和B的质量比是10g:2g=5:1.
故选D.
点评: 本题解题的关键是运用化学中的基本思想:质量守恒思想.
10.(2分)(2013•天津)除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项 | 物质 | 杂质 | 除杂试剂及操作方法 |
A | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
B | 氢气 | 氯化氢 | 先通过过量氢氧化钠溶液,再通过过量浓硫酸 |
C | 锌粉 | 铁粉 | 加入适量氯化锌溶液,充分反应后过滤 |
D | 氯化钾溶液 | 碳酸钾 | 加入过量氯化钙溶液,充分反应后过滤 |
A. A B. B C. C D. D
考点: 物质除杂或净化的探究.
专题: 物质的分离、除杂、提纯与共存问题.
分析: 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答: 解:A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;且除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故选项所采取的方法错误.
B、HCl能与氢氧化钠溶液反应生成氯化钠和水,氢气不与氢氧化钠溶液反应,再通过过量浓硫酸除去水分,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
C、铁粉不能与氯化锌溶液反应,不能除去杂质,不符合除杂原则,故选项所采取的方法错误.
D、碳酸钾能与过量氯化钙溶液反应生成碳酸钙沉淀和氯化钾,能除去杂质但引入了新的杂质氯化钙,不符合除杂原则,故选项所采取的方法错误.
故选B.
点评: 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
二、选择题(本大题共5小题,每小题2分,共10分.每小题给出的四个选项中,有1~2个符合题意)
11.(2分)(2013•天津)下列有关金属材料的叙述错误的是( )
A. 回收利用废旧电池中的铅、汞等可减少对环境的污染
B. 铝块能制成铝箔是利用了铝的延展性
C. 铝比钢铁中的铁活泼,因而铝的抗腐蚀性能比铁差
D. 在铁制品表面刷漆或镀耐腐蚀性金属都可以防止铁制品锈蚀
考点: 金属的回收利用及其重要性;金属的物理性质及用途;金属的化学性质;金属锈蚀的条件及其防护.
专题: 金属与金属材料.
分析: A、废旧电池中铅、汞的回收有利于保护环境;
B、金属具有良好的导电性、导热性、延展性;
C、铝具有自我保护作用,铝表面易形成致密的氧化膜;
D、铁制品表面刷漆或镀耐腐蚀性金属都可以防止铁制品锈蚀.
解答: 解:A、废旧电池中铅、汞的回收有利于保护环境,故A正确;
B、铝块能制成铝箔是利用了铝的延展性,故B正确;
C、虽然铝比钢铁中的铁活泼,但铝具有自我保护作用,铝表面易形成致密的氧化膜,所以铝的抗腐蚀性能比铁强,故C错误;
D、铁制品表面刷漆或镀耐腐蚀性金属都可以防止铁制品锈蚀,故D正确.
故选C.
点评: 解答本题要充分理解铁、铝的性质,并且要充分理解节能环保的重要性.
12.(2分)(2013•天津)下列事实与相应的解释不一致的是( )
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 混合后分子变小了 |
B | 氢氧化钠和氢氧化钙化学性质相似 | 在其溶液中都含有OH﹣ |
C | 氮气常用作焊接金属时的保护气 | 氮气的化学性质不活泼 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵和熟石灰发生中和反应 |
A. A B. B C. C D. D
考点: 利用分子与原子的性质分析和解决问题;常见气体的用途;碱的化学性质;铵态氮肥的检验.
专题: 物质的微观构成与物质的宏观组成;常见的碱 碱的通性;常见的盐 化学肥料.
分析: A、根据分子的基本性质进行分析判断.
B、根据碱具有通性的原因进行分析.
C、根据氮气的性质和用途进行分析判断.
D、根据铵态氮肥能和熟石灰发生反应而降低肥效结合中和反应的概念进行分析判断.
解答: 解:A、10mL酒精和10mL水混合后体积小于20mL,是因为分子之间有间隔,一部分水分子和酒精分子会互相占据分子之间的间隔,故选项解释错误.
B、氢氧化钠和氢氧化钙的溶液中都含有氢氧根离子,因此它们的化学性质相似,故选项解释正确.
C、氮气的化学性质不活泼,因此氮气常用作焊接金属时的保护气,故选项解释正确.
D、硫酸铵属于铵态氮肥,能和熟石灰发生反应而降低肥效,但硫酸铵与熟石灰反应属于复分解反应,不是中和反应,故选项解释错误.
故选AD.
点评: 本题难度不大,掌握利用分子的基本性质分析和解决问题的方法、碱具有通性的原因、氮气的性质与用途以及铵态氮肥使用注意事项等是解答本题的关键.
13.(2分)(2013•天津)甲、乙两种物质的溶解度曲线如图所示.下列说法中正确的是( )
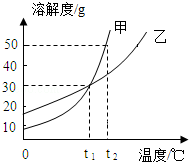
A. t1℃时,甲和乙的饱和溶液升温到t2℃时仍是饱和溶液
B. t1℃时,甲和乙各30g分别加入100g水中,充分溶解,均形成饱和溶液
C. t2℃时,甲和乙的饱和溶液各100g,其溶质的质量相等
D. t2℃时,在100g水中加入60g甲,充分溶解,形成不饱和溶液
考点: 固体溶解度曲线及其作用;饱和溶液和不饱和溶液.
专题: 溶液、浊液与溶解度.
分析: A、据甲、乙的溶解度随温度升高的变化情况分析解答;
B、据t1℃时,甲和乙的溶解度分析判断;
C、据t2℃时,甲和乙的溶解度分析解答;
D、据t2℃时甲的溶解度及溶解度的含义分析解答.
解答: 解:A、甲、乙的溶解度均随温度的升高而增大,故t1℃时,甲和乙的饱和溶液升温到t2℃时变为不饱和溶液,故错误;
B、t1℃时,甲和乙的溶解度相等,均为30g,所以将甲和乙各30g分别加入100g水中,充分溶解,均形成饱和溶液,正确;
C、t2℃时,甲的溶解度大于乙的溶解度,所以二者的饱和溶液各100g,所含溶质的质量不相等,甲>乙,故错误;
D、t2℃时甲的溶解度是50g,所以在100g水中加入60g甲,充分溶解,最多溶解50g,形成的是饱和溶液,故错误;
故选B.
点评: 溶解度是一定温度下,100g溶剂中最多溶解物质的质量,此外,了解饱和溶液、不饱和溶液的相互转化,溶解度曲线的意义即可顺利解答.
14.(2分)(2013•天津)某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验.下列选项错误的是( )
选项 | 所用试剂 | 现象和结论 |
A | 硫酸铜溶液 | 出现蓝色沉淀,则氢氧化钠过量 |
B | 氯化钡溶液 | 出现白色沉淀,则硫酸过量 |
C | 锌粒 | 有气泡产生,则硫酸过量 |
D | 无色酚酞溶液 | 溶液不变色,则恰好完全反应 |
A. A B. B C. C D. D
考点: 中和反应及其应用;酸的化学性质;盐的化学性质.
专题: 常见的酸 酸的通性.
分析: 硫酸与氢氧化钠反应生成硫酸钠和水,硫酸钠呈中性,当硫酸剩余时呈酸性,可根据酸的化学性质来检验硫酸是否有剩余,当氢氧化钠有剩余时可根据氢氧化钠的性质检验.
解答: 解:A、只有氢氧化钠过量时,硫酸铜与氢氧化钠反应生成蓝色沉淀,故A正确;
B、当硫酸不过量时,硫酸与氢氧化钠反应生成的硫酸钠也会和氯化钡反应生成硫酸钡白色沉淀,故B错误;
C、只有当硫酸剩余时,硫酸与锌粒反应才产生气泡,故C正确;
D、硫酸与氢氧化钠恰好完全反应生成硫酸钠和水,硫酸钠呈中性,不能使酚酞试液变色;但若硫酸过量,溶液呈现酸性,也不能使酚酞试液变色,故D错误;
故选BD.
点评: 本题考查酸碱中和反应后溶液中溶质的种类及溶液酸碱性的判断,掌握酸、碱、盐的相关化学性质是解答本题的关键.
15.(2分)(2013•天津)某K2CO3样品,可能含有Na2CO3、MgCO3、CuSO4、NaCl中的几种杂质.取该样品6.9g,加入50g稀盐酸中,恰好完全反应得到无色溶液,同时产生2.2g气体.下列判断正确的是( )
A. 反应后得到无色溶液,说明样品中一定没有CuSO4
B. NaCl不与盐酸反应,说明样品中一定没有NaCl
C. 所加稀盐酸中溶质的质量分数为7.3%
D. Na2CO3和MgCO3都能和稀盐酸反应生成气体,说明样品中一定有Na2CO3和MgCO3
考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题: 推断混合物的可能组成.
分析: 硫酸铜溶液为蓝色,恰好完全反应得到无色溶液,说明样品中无硫酸铜,两者恰好完全反应,根据生成的二氧化碳求得盐酸的质量分数和所需碳酸钾的质量,然后推测其他的成分.
解答: 解:硫酸铜溶液为蓝色,恰好完全反应得到无色溶液,说明样品中无硫酸铜,故A正确;
设生成2.2g二氧化碳需要碳酸钾的质量为x,纯盐酸的质量为y,则有
K2CO3+2HCl=2KCl+CO2↑+H2O
138 73 44
x y 2.2g
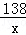 =
=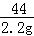 x=6.9g
x=6.9g
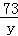 =
=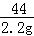 y=3.65g
y=3.65g
根据计算可以知道即使全部是碳酸钾也只能生成2.2g二氧化碳,但是题干中给的信息是:K2CO3固体样品不纯,所以根据近似平均值法,则其中混有的杂质:一种产生二氧化碳的能力比碳酸钾强,另一种产生二氧化碳的能力比碳酸钾弱;根据质量守恒定律可以知道,碳酸根中的碳元素和二氧化碳中的碳元素的质量相等,可以通过比较碳酸根的含量,来确定生成二氧化碳气体质量的多少,在碳酸钾中,含碳酸根为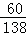 ×100%=43.5%,在碳酸钠中,含碳酸根为
×100%=43.5%,在碳酸钠中,含碳酸根为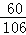 ×100%=56.6%,在碳酸镁中,含碳酸根为
×100%=56.6%,在碳酸镁中,含碳酸根为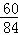 ×100%=71.4%,碳酸钠和碳酸镁中碳酸根的含量都比碳酸钾中碳酸根的含量高,即在质量相同的条件下碳酸根含量多的物质,生成二氧化碳气体的质量也要大,所以可以判断一定含有氯化钠,但是对于碳酸钠和碳酸镁这两种物质中可能含有一种,也可能是两种都存在,故选项B、D的判断是错误的;
×100%=71.4%,碳酸钠和碳酸镁中碳酸根的含量都比碳酸钾中碳酸根的含量高,即在质量相同的条件下碳酸根含量多的物质,生成二氧化碳气体的质量也要大,所以可以判断一定含有氯化钠,但是对于碳酸钠和碳酸镁这两种物质中可能含有一种,也可能是两种都存在,故选项B、D的判断是错误的;
所加稀盐酸中溶质的质量分数是: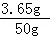 ×100%=7.3%,C正确;
×100%=7.3%,C正确;
故选AC.
点评: 熟练掌握碳酸盐的性质,学会利用近似平均值的方法结合质量守恒定律定律来解答这类题目:先假设全部是主要的物质,然后根据计算的数据,判断是否含有其他的物质,这是解答此题的关键.












