三、解答题(共3小题,满分30分)
19.(12分)(2013•内江)海水是巨大的资源宝库.如图所示利用海水为原料科获得许多化工产品:
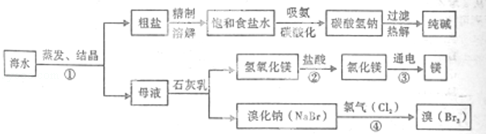
(1)要鉴别海水是硬水还是软水,可选用的试剂是 肥皂水 .
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 氯化钠的溶解度受温度影响很小 .
(3)制纯碱过程中,其中过滤操作所需要的仪器有烧杯、漏斗和 玻璃棒 .
(4)步骤②发生反应的化学方程式是 Mg(OH)2+2HCl=MgCl2+2H2O ,其基本反应类型为 复分解反应 ,用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具备的优良性能有 强度高而密度又小,或机械性能好,或韧性和抗蚀性能很好 (任答一点)
(5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 2NaBr+Cl2═2NaCl+Br2 ,此反应能够发生是因为 氯气的非金属性比溴的非金属性强 .
考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;酸的化学性质;氯化钠与粗盐提纯;盐的化学性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
专题: 常见的盐 化学肥料.
分析: 用肥皂水可以区分硬水和软水;
书写化学方程式要注意规范性;
合金的性能一般优于组成它的纯金属.
解答: 解:(1)向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生的泡沫很少或不产生泡沫,是硬水.
故填:肥皂水.
(2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是:氯化钠的溶解度受温度影响很小.
故填:氯化钠的溶解度受温度影响很小.
(3)过滤操作所需要的仪器有烧杯、漏斗和玻璃棒.
故填:玻璃棒.
(4)氢氧化镁和盐酸反应能生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O.
故填:Mg(OH)2+2HCl=MgCl2+2H2O.
该反应是两种化合物相互交换成分,生成另外两种化合物的反应,属于复分解反应.
故填:复分解反应.
镁铝合金的优良性能有:强度高而密度又小,机械性能好,韧性和抗蚀性能很好.
故填:强度高而密度又小,或机械性能好,或韧性和抗蚀性能很好.
(5)溴化钠和氯气反应能生成溴和氯化钠,反应的化学方程式为:2NaBr+Cl2═2NaCl+Br2.
故填:2NaBr+Cl2═2NaCl+Br2.
此反应能够发生是因为氯气的非金属性比溴的非金属性强.
故填:氯气的非金属性比溴的非金属性强.
点评: 本题主要考查物质的性质和化学方程式的书写,书写化学方程式时要注意四步,一是反应物和生成物的化学式要正确,二是遵循质量守恒定律,三是写上必要的条件,四是看是否有“↑”或“↓”.
20.(12分)(2013•内江)某化学实验活动小组的同学为了探究实验室中久置氢氧化钠固体的成分,进行了有关实验,请你参与他们进行的探究活动:
【猜想与假设】
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3
猜想Ⅲ: 固体为氢氧化钠和碳酸钠 .
【实验与探究】
(1)实验如下:
实验操作步骤 | 实验现象 | 结论及解释 |
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. | 实验过程中始终没有气泡产生. | 则证明猜想 Ⅰ 成立. |
步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液. | 实验过程中产生 白色沉淀 . | 则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为 Na2CO3+Ba(OH)2═BaCO3↓+2NaOH . |
(2)为了进一步的验证猜想结果,小明同学提出了如下实验方案:继续步骤二的实验,过滤,然后向滤液中滴加无色酚酞试液,若酚酞变红,则猜想Ⅲ成立;若酚酞不变红,则猜想Ⅱ成立.
小华同学立即对小明同学的方案提出了质疑,通过查阅资料知道,氯化钡溶液程中性,不能使无色酚酞试液变红,但碳酸钠溶液呈 碱 性(填“酸”或“减”)能使酚酞变红.因此,他认为该方案的操作步骤中应该改进的是 将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液 .
(3)实验小组的同学展开讨论,又提出了一个定量试验方案,通过测定产生沉淀的质量来证明猜想Ⅱ或Ⅲ成立.试验如下:准确称量m克固体样品于试管中,加热蒸馏水完全溶解,然后滴加足量氯化钡溶液,充分反映后过滤、洗涤、干燥称的沉淀的质量为n克,若猜想Ⅱ成立,则m与n的关系式为(用含m和n的等式或不等式表示,下同) n=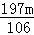 ;若猜想Ⅲ成立,则m与n的关系式又为 n<
;若猜想Ⅲ成立,则m与n的关系式又为 n<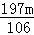 .
.
【反思与交流】久置固体氢氧化钠变质的原因是(用化学方程式表示) 2NaOH+CO2═Na2CO3+H2O .
考点: 药品是否变质的探究;碱的化学性质;盐的化学性质.
专题: 科学探究.
分析: 【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,所以可以据此结合题中的猜想完成解答;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,而氢氧化钠和稀盐酸反应时没有明显现象,氢氧化钡溶液和碳酸钠反应生成白色沉淀,可以据此解答该题;
(2)碳酸钠溶液呈碱性,可以是酚酞变红,所以为了防止碳酸钠干扰实验应该加入过量的氯化钡溶液,可以据此进行解答;
(3)根据氯化钡和碳酸钠溶液反应的化学方程式可以得出m和n的关系,然后根据题中的信息进行解答即可;
[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,可以据此写出该反应的化学方程式.
解答: 解:【猜想与假设】氢氧化钠若变质,其产物为碳酸钠,若氢氧化钠部分变质,则该固体为氢氧化钠和碳酸钠混合物;
【实验与探究】(1)碳酸钠可以和稀盐酸反应生成气体,所以若没有明显现象,则该固体中没有碳酸钠,即只有氢氧化钠,即猜想Ⅰ成立;
氢氧化钡溶液和碳酸钠反应生成白色沉淀碳酸钡和氢氧化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,即猜想Ⅱ或猜想Ⅲ成立;该反应的化学方程式为:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;
(2)碳酸钠溶液呈碱性,可以是酚酞变红,所以为了防止碳酸钠干扰实验应该将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液溶液;
(3)假设所取的mg固体全部为碳酸钠,则:
Na2CO3+BaCl2═BaCO3↓+2NaCl
106 197
m n
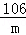 =
=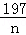
即:n=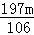
若猜想Ⅱ成立,即全部是碳酸钠,那么n和m的关系为:n=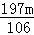 ;
;
若猜想Ⅲ成立,即所取固体为碳酸钠和氢氧化钠的混合物,所以生成的碳酸钡的质量n<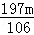 ;
;
[[反思]氢氧化钠溶液变质是由于和空气中的二氧化碳发生反应生成了碳酸钠的缘故,该反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O.
故答案为:【猜想与假设】固体为氢氧化钠和碳酸钠;
【实验与探究】(1)
实验操作步骤 实验现象 结论及解释
步骤一:取少量固体样品于试管中,加蒸馏水完全溶解,然后加入足量的稀盐酸. 实验过程中始终没有气泡产生. 则证明猜想Ⅰ成立.
步骤二:取少量固体样品于试管中,加蒸馏水完全溶解,然后滴加氢氧化钡溶液. 实验过程中产生
白色沉淀. 则证明猜想Ⅱ或Ⅲ成立,此过程中发生反应的化学方程式为 Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
(2)碱;将步骤二中的氢氧化钡溶液改为加入过量的氯化钡溶液;
(3)n=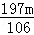 ;n<
;n<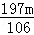 ;
;
[[反思]2NaOH+CO2═Na2CO3+H2O.
点评: 在检验氢氧化钠是否是部分变质与检验是否变质是有区别的,检验变质只需用盐酸就可以了,而检验部分变质,还要检验是否有氢氧化钠,常用氯化钙溶液或是氯化钡溶液来进行检验.
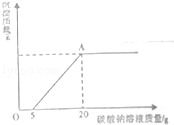
21.(6分)(2013•内江)为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20克于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如右图所示:
根据题中有关信息和图象分析回答下列问题:
(1)原溶液中的溶质成分有 CaCl2、HCl (用化学式回答).
(2)A点处溶液中溶质的质量分数是多少?﹙通过计算回答﹚
考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题: 综合计算(图像型、表格型、情景型计算题).
分析: (1)根据题干提供的信息结合图象进行分析,石灰石与盐酸反应后的废液中一定含有溶质氯化钙,加入碳酸钠开始没有沉淀生成,说明废液中含有多余的盐酸;
(2)根据图象:开始时盐酸消耗的碳酸钠溶液的质量是5g,氯化钙消耗的碳酸钠溶液的质量是15g,然后据溶质的质量=溶液的质量×溶质的质量分数计算出相应的碳酸钠溶液中碳酸钠的质量,结合方程式计算出生成的氯化钠的质量,二氧化碳的质量、碳酸钙的质量,据溶质的质量分数解答即可.
解答: 解:(1)石灰石与盐酸反应后的废液中一定含有溶质氯化钙,加入碳酸钠开始没有沉淀生成,说明废液中含有多余的盐酸,故含有的溶质有氯化钙和氯化氢;
(2)A点处废液中的溶质恰好完全反应,盐酸消耗的碳酸钠溶液的质量是5g,碳酸钠溶液含有碳酸钠的质量是5g×10.6%=0.53g;
设碳酸钠溶液与盐酸反应生成氯化钠的质量为x,生成二氧化碳的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
0.53g x y
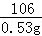 =
=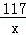 x=0.585g
x=0.585g
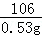 =
=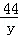 y=0.22g
y=0.22g
氯化钙消耗的碳酸钠溶液的质量是15g,碳酸钠溶液含有碳酸钠的质量是15g×10.6%=1.59g;
设碳酸钠溶液与氯化钙反应生成氯化钠的质量为a,生成碳酸钙的质量为b
Na2CO3+CaCl2=CaCO3↓+2NaCl,
106 100 117
1.59g a b
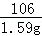 =
=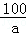 a=1.5g
a=1.5g
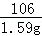 =
=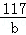 b=1.755g
b=1.755g
A点处溶液的质量是:20g+20g﹣0.22g﹣1.5g=38.28g
所得溶液中氯化钠的质量分数为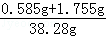 ×100%≈6.1%
×100%≈6.1%
故答案为:(1)CaCl2、HCl;
(2)A点处溶液中溶质的质量分数是6.1%.
点评: 本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,结合图象,增加了学生分析问题的思维跨度,考查了学生整合知识的能力,难度较大.












