二、填空题(共6小题,满分52分)
13.(6分)(2013•内江)从H、C、N、O、P、K六种元素中选择元素组成符合要求的物质,用化学式填空:
(1)俗称干冰,通常用作致冷剂和人工降雨剂的是 CO2 .
(2)属于钾盐,农业上可用作复合肥料的是 KNO3 .(任写一种)
考点: 化学式的书写及意义.
专题: 化学用语和质量守恒定律.
分析: 首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法写出物质的化学式即可.
解答: 解:(1)固态的二氧化碳俗称干冰,升华吸热,通常用作致冷剂和人工降雨剂,其化学式为:CO2.
(2)硝酸钾属于钾盐,且其中含有钾元素和氮元素两种植物营养元素,属于复合肥,其化学式为:KNO3.
故答案为:(1)CO2;(2)KNO3.
点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.
14.(6分)(2013•内江)图中A、B、C、D为四种粒子的微粒结构示意图,E为钙元素在周期表中的信息,请按要求填空:
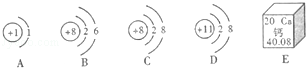
A、B、C、D共表示 3 种元素的粒子,从E图中你可以获得的信息有 钙元素的核电荷数是20(合理即可) .(任写一条)
考点: 原子结构示意图与离子结构示意图;元素周期表的特点及其应用.
专题: 化学用语和质量守恒定律.
分析: 根据不同的元素质子数不同,所以可判断元素的种类,依据元素周期表中的各部分的意义可得到相关的信息;
解答: 解:质子数不同则元素种类不同,BC都是含有8个质子的氧的微粒,是同种元素,所以ABCD中共含有三种元素,由该元素的周期表信息可知钙元素的核电荷数是20,元素符号是Ca,名称是钙,其相对原子质量是40.08;
故答案为:3;钙元素的核电荷数是20(合理即可);
点评: 了解元素周期表的特点及其应用;掌握元素的概念:具有相同核电荷数(即质子数)的一类原子总称;都是解决此类问题的关键;
15.(6分)(2013•内江)银、铁、铜是日常生活中经常接触到的三种金属.对Ag、Fe、Cu三种金属活动顺序的探究,下列所选试剂组不可行的是 ② .
①Fe、Ag、CuSO4溶液 ②Cu、Ag、FeSO4溶液 ③Cu、FeSO4溶液、AgNO3溶液
在你认为可行的试剂组中,写出其中发生反应的化学方程式 Fe+CuSO4=FeSO4+Cu
(若可行的试剂不只一组,请任选其中一组)
考点: 金属活动性顺序及其应用.
专题: 金属与金属材料.
分析: 根据金属活动顺序进行思考,Ag、Fe、Cu这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以选择相应的金属和盐溶液进行反应来证明这三种金属的活动性强弱.
解答: 解:①Fe、Ag、CueSO4溶液这三种物质中,Fe与CuSO4溶液反应,证明铁的活动性比铜强,Ag与CuSO4溶液不能反应,证明铜比银的活动性强.所以,所选试剂组可行.发生反应的方程式是:Fe+CuSO4=FeSO4+Cu;
②、因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,所以此试剂组不可行;
③、Cu、FeSO4溶液、AgNO3溶液这三种物质中,Cu与FeSO4溶液不反应,证明铁的活动性比铜强,Cu与AgNO3溶液能反应,证明铜比银的活动性强,可以证明三种金属的活动性强弱,此试剂组可行.
故答为:②,Fe+CuSO4=FeSO4+Cu.
点评: 要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.
16.(6分)(2013•内江)质量守恒定律的定量研究对化学科学发展具有重大意义.
(1)我国从2011年5月1日起,酒驾入刑.“酒精检测仪”可检查司机是否酒后驾车,其反应原理为C2H5OH+4CrO3+6H2SO4═2Cr2(SO4)3+2X↑+9H2O,反应中红色的CrO3转变为绿色的Cr2(SO4)3,其中X的化学式为 CO2 .
(2)请从微观上分析,任何化学反应都遵循质量守恒定律的原因 在化学变化过程中原子种类、原子个数和原子质量都没有发生改变,所以物质的总质量不变,即质量守恒 .
考点: 质量守恒定律及其应用.
专题: 化学用语和质量守恒定律.
分析: (1)根据反应前后原子的种类和数目不变来进行判断X的化学式;
(2)从化学反应的实质入手,化学变化的实质是分子分成原子,原子再重新组合成新的分子,所以反应前后原子的种类、数目、质量都不变.
解答: 解:(1)根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为C,2;H,18;Cr,4;O,37;S,4;已知生成物中含有的原子种类及原子个数为H,18;Cr,4;O,33;S,4;比较分析可知X中含有C和O元素,其原子个数分别为2,4;故X的化学式为CO2.
(2)在化学变化中分子破裂成原子,原子重新组合新的分子,在该过程中原子种类、原子个数和原子质量都没有发生改变,所以物质的总质量不变.
故答案为:(1)CO2;
(2)在化学变化过程中原子种类、原子个数和原子质量都没有发生改变,所以物质的总质量不变,即质量守恒.
点评: 本题主要考查学生对质量守恒定律的认识和灵活运用这一定律解答问题的能力,质量守恒定律适用于所有的化学变化.
17.(18分)(2013•内江)下面是几种实验室制取气体的发生装置和收集装置,请回答下列问题:
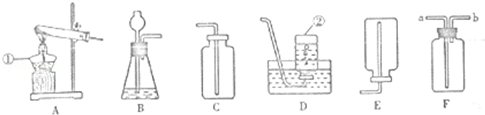
(1)指出图中标有数字的仪器名称;
① 酒精灯 :② 集气瓶 .(2)实验室用双氧水和二氧化锰制取氧气时应选用 B (填字母标号,下同)做发生装置,写出该反应的化学方程式 2H2O2\frac{\underline{\;MnO_2\;}}{\;}2H2O+O2↑ ;若要收集较为纯净的氧气最好选用 D 装置.
(3)F是一种可用于集气、洗气等的多功能装置.若将F装置内装满水,再连接量筒,用可用于测定不溶于水且不与水反应的气体体积,测量时气体应从 b (填“a”或“b”)进入F中.
考点: 氧气的制取装置;氧气的收集方法.
专题: 常见气体的实验室制法、检验、干燥与净化.
分析: (1)根据常用仪器的名称和用途分析解答;
(2)根据实验室制取气体的发生装置是由反应物的状态和反应条件决定的分析;根据实验室用双氧水和二氧化锰制取氧气的反应原理分析;根据排水法收集的氧气较为纯净分析;
(3)排水法量取气体体积气体应“浅入深出”,据此进行分析解答.
解答: 解:(1)根据常用仪器可知①是酒精灯、②是集气瓶;
故答案为:酒精灯;集气瓶;
(2)实验室用双氧水和二氧化锰制取氧气属于固液在常温下反应制取气体,发生装置应选B;该反应的化学方程式为2H2O2\frac{\underline{\;MnO_2\;}}{\;}2H2O+O2↑;氧气的密度比空气大,不易溶于水,可用向上排空气法和排水法收集,但排水法收集的氧气较为纯净;
故答案为:B;2H2O2\frac{\underline{\;MnO_2\;}}{\;}2H2O+O2↑;D;
(3)气体应“浅入深出”,因此该气体应从b端进入F中;
故答案为:b.
点评: 本题考查注重基础,主要考查了实验室制取气体的装置选取及实验和注意事项,难度不大.
18.(10分)(2013•内江)2013年4月20日,我国雅安市芦山县发生了7.0级大地震,为防止灾后疫情发生,防疫人员使用了多种消毒剂进行环境消毒,其中亚氯酸钠(NaClO2)是一种重要的消毒剂,试计算:
(1)亚氯酸钠的相对分子量 90.5 .
(2)亚氯酸钠中氧元素的质量分数为 35.4% .
(3)若要配制质量分数为15%的亚氯酸钠200kg用于环境消毒,则需要亚氯酸钠多少kg,同时需要水多少L?
考点: 相对分子质量的概念及其计算;有关溶质质量分数的简单计算;元素的质量分数计算.
专题: 化学式的计算;溶液的组成及溶质质量分数的计算.
分析: (1)根据物质的化学式,相对分子质量=相对原子质量与相应原子个数的乘积和进行计算;
(2)据物质中某元素的质量分数= ×100%进行解答;
×100%进行解答;
(3)溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量﹣溶质的质量,并据水的密度分析解答(本题原题是计算水的多少毫升,由于不符合生活中配制溶液的实际,现将单位由毫升更改为升).
解答: 解:(1)亚氯酸钠的相对分子量=23+35.5+16×2=90.5;
(2)亚氯酸钠中氧元素的质量分数为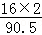 ×100%≈35.4%;
×100%≈35.4%;
(3)要配制质量分数为15%的亚氯酸钠200kg,需要亚硝酸钠的质量为:200kg×15%=30kg,需要水的质量是200kg﹣30kg=170kg,由于水的密度是1g/cm3,即1kg/L,所以需要水的体积是170L;
故答案为:(1)90.5;(2)35.4%;(3)30kg;170L.
点评: 了解相对分子质量、元素的质量分数、溶质质量分数的计算式,才能结合题意正确解答.












