14.(2分)(2013•呼和浩特)碳元素是形成化合物种类最多的元素,含碳物质是中学化学中研究的重要内容.
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 CO2 (填化学式)的排放量.
(2)丁烷(C4H10)是液化石油气的成分之一,丁烷完全燃烧后与甲烷完全燃烧后的产物相同,其化学反应方程式是 2C4H10+13O2 8CO2+10H2O .
8CO2+10H2O .
考点: 二氧化碳对环境的影响;书写化学方程式、文字表达式、电离方程式.
专题: 碳单质与含碳化合物的性质与用途.
分析: (1)二氧化碳排放过多,会造成温室效应,“低碳生活”主要是为了减少二氧化碳的排放.
(2)根据题意,丁烷完全燃烧后与甲烷完全燃烧后的产物(二氧化碳和水)相同,写出反应的化学方程式即可.
解答: 解:(1)“低碳生活”倡导低能量、低消耗,主要是为了减少二氧化碳(CO2)的排放.
(2)根据题意,丁烷完全燃烧后与甲烷完全燃烧后的产物(二氧化碳和水)相同,反应的化学方程式为2C4H10+13O2 8CO2+10H2O.
8CO2+10H2O.
故答案为:(1)CO2;(2)2C4H10+13O2 8CO2+10H2O.
8CO2+10H2O.
点评: 本题难度不大,了解二氧化碳对环境的影响、化学方程式的书写方法等即可正确解答本题.
15.(4分)(2013•呼和浩特)某化学小组同学从微观角度进一步理解复分解反应的实质.
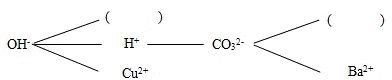
(1)复分解反应的实质是某些阴、阳离子结合生成沉淀、气体或 水 的过程.
(2)根据复分解反应的实质,形成一个复分解反应网络图(如图所示,图中直线相连的阴、阳离子之间能够两两结合发生反应),请选择合适的离子填入如图括号内( NH4+ , Ca2+ ),使其两两结合时,一个有气体产生,一个有沉淀(注:沉淀与珍珠粉的成分相同)生成,其中有气体生成的化学反应方程式可能是 NaOH+NH4Cl═NaCl+NH3↑+H2O .
考点: 复分解反应的条件与实质.
专题: 化学反应的基本类型和能量变化.
分析: (1)根据复分解反应发生的条件进行解答;
(2)珍珠粉的主要成分为碳酸钙,所以应该选择钙离子和碳酸根离子结合生成沉淀,而 能够和氢氧根离子生成沉淀为铵根离子,可以据此完成解答.
能够和氢氧根离子生成沉淀为铵根离子,可以据此完成解答.
解答: 解:(1)根据复分解反应发生的条件可以知道,两种物质反应时必须有水、气体或是沉淀生成,否则复分解反应就不能发生;
(2)珍珠粉的主要成分为碳酸钙,所以应该选择钙离子和碳酸根离子结合生成沉淀,而能够和氢氧根离子生成沉淀为铵根离子,氢氧化钠和铵盐,例如和氯化铵反应,能够生成氨气、水和氯化钠,该反应的化学方程式为:NaOH+NH4Cl═NaCl+NH3↑+H2O.
故答案为:(1)水;
(2)NH4+;Ca2+;NaOH+NH4Cl═NaCl+NH3↑+H2O.
点评: 对于复分解反应的两个条件,要同时兼顾,切不可顾此失彼.为了正确判断复分解反应的发生,必须熟记常见酸、碱、盐的溶解性表,并能正确地运用物质的溶解性.
三、实验题(本题包括2个小题,共10分)
16.(5分)(2013•呼和浩特)实验室制取气体时所需的一些装置如图所示,请回答下列问题:
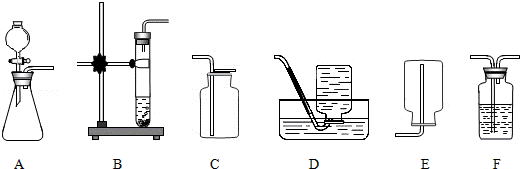
(1)实验室里用过氧化氢溶液和二氧化锰混合制取氧气的化学方程式为 2H2O2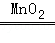 2H2O+O2↑ ;可选择的发生装置有 A和B (填字母);选择气体收集方法时,气体的下列性质:①颜色;②密度;③溶解性;④可燃性,必须考虑的是 ②③ (填序号).
2H2O+O2↑ ;可选择的发生装置有 A和B (填字母);选择气体收集方法时,气体的下列性质:①颜色;②密度;③溶解性;④可燃性,必须考虑的是 ②③ (填序号).
(2)MnO2在该反应中可以重复使用,理由是 二氧化锰作为催化剂,在化学反应前后质量和化学性质都没有发生改变 .
(3)要制备干燥的氧气,所选择装置的连接顺序为 A→F→C或B→F→C (填字母).
考点: 氧气的制取装置;氧气的收集方法.
专题: 常见气体的实验室制法、检验、干燥与净化.
分析: (1)实验室用过氧化氢溶液和二氧化锰混合生成水和氧气,二氧化锰起催化作用,写出反应的方程式;根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集装置;
(2)根据催化剂的定义及性质分析;
(3)根据制取气体、干燥气体、收集气体的依据分析.
解答: 解:(1)实验室用过氧化氢溶液和二氧化锰混合生成水和氧气,二氧化锰起催化作用,方程式是:2H2O2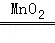 2H2O+O2↑;发生装置的特点属于“固液常温型”,故可选发生装置有A和B;收集气体的依据是气体的密度和溶解性,故选择②③;
2H2O+O2↑;发生装置的特点属于“固液常温型”,故可选发生装置有A和B;收集气体的依据是气体的密度和溶解性,故选择②③;
故答案为:2H2O2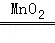 2H2O+O2↑;A和B;②③;
2H2O+O2↑;A和B;②③;
(2)二氧化锰在此反应中作为催化剂,改变了化学反应的速率,而二氧化锰本身的质量和化学性质在反应前后都没有发生改变,故MnO2在该反应中可以重复使用;
故答案为:二氧化锰作为催化剂,在化学反应前后质量和化学性质都没有发生改变;
(3)A或B装置是用来制取氧气的装置,由于浓硫酸具有吸水性,可以用来干燥气体,所以再通过浓硫酸把氧气干燥后再进行收集,由于要收集干燥的氧气,根据氧气的密度比空气大,用向上排空气法收集,所以仪器的连接顺序为A→F→C或B→F→C;
故答案为:A→F→C或B→F→C.
点评: 本考点主要考查气体的制取装置和收集装置、干燥装置的选择,同时也考查了化学方程式的书写,关键是明确气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.
17.(5分)(2013•呼和浩特)某化学兴趣小组在课外活动中对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
检测次数 | 溶液中检测出的物质 |
第一次 | KCl、K2SO4、Na2CO3、NaCl |
第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
第三次 | Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 二 次检测结果不正确.
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,先向溶液中加入过量的稀硝酸溶液,检验的离子是 碳酸根离子 ;然后继续加入过量的 Ba(NO3)2 溶液(填化学式),其目的是 检验并除尽硫酸根离子 ;过滤后,再向滤液中加入 AgNO3 溶液(填化学式).
考点: 常见离子的检验方法及现象.
专题: 物质的检验、鉴别与推断.
分析: 在检验氯离子时,我们可用硝酸银和稀硝酸.在检验硫酸根离子时,我们可用硝酸钡和稀硝酸.为了排除碳酸根离子的干扰,我们可以先加硝酸排除干扰.
解答: 解:(1)氯化钡与硫酸钠在同一溶液中不能共存,可以相互反应,所以判断第二个方案是错误的;
(2)为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,要确定氯离子和硫酸根离子,必须排除碳酸根离子的干扰,所以首先应检验并除去碳酸根离子.所以可先加过量的硝酸,观察是否有气体生成,检验并除去碳酸根离子.在检验氯离子和硫酸根离子时,要先检验硫酸根离子,因硝酸银能跟硫酸根离子生成硫酸银,是一种微溶性物质干扰检验.所以先加过量的硝酸钡溶液,检验并除去硫酸根离子.最后再用硝酸银来检验氯离子;
故答案为(1)二;(2)碳酸根离子; Ba(NO3)2; 检验并除尽硫酸根离子;AgNO3.
点评: 在确定溶液的组成时,首先要保证所确定的溶液中的溶质必须保证能在同一溶液中共存,也就是所确定的溶质不能发生化学反应,在检验硫酸根离子和氯离子时,通常先检验硫酸根离子,排除硫酸银微溶性物质的干扰.
四、计算题(本题仅有1个小题,共6分)
18.(6分)(2013•呼和浩特)取若干克氯酸钾和二氧化锰的固体混合物,在试管中加热至不再有气体放出,将试管内的剩余固体冷却后溶于水,过滤、洗涤、干燥得到纯净固体3.25g,还得到100g溶质质量分数为7.45%的滤液.试计算(写出必要的计算过程):
(1)反应后产生气体的质量.
(2)原混合物中氯元素的质量分数.
考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
专题: 有关化学方程式的计算.
分析: 将试管内的剩余固体冷却后溶于水,过滤、洗涤、干燥得到纯净固体3.25g,可以知道该固体为二氧化锰,由于反应至不再产生气体,说明氯酸钾 以完全分解,那么所得溶液为氯化钾溶液,可以知道氯化钾的质量为:100g×7.45%=7.45g;可以据此结合化学方程式进行解答.在求算氯元素的质量分数时,可结合化合物中元素质量分数的计算方法求出氯酸钾中氯元素的质量,然后带入固体的总质量求算即可.
以完全分解,那么所得溶液为氯化钾溶液,可以知道氯化钾的质量为:100g×7.45%=7.45g;可以据此结合化学方程式进行解答.在求算氯元素的质量分数时,可结合化合物中元素质量分数的计算方法求出氯酸钾中氯元素的质量,然后带入固体的总质量求算即可.
解答: 根据分析可以知道试管中剩余的为氯化钾和二氧化锰,由“将试管内的剩余固体冷却后溶于水,过滤、洗涤、干燥得到纯净固体3.25g”, 可以知道该固体为二氧化锰,由于反应至不再产生气体,说明氯酸钾以完全分解,那么所得溶液为氯化钾溶液,可以知道氯化钾的质量为:100g×7.45%=7.45g;
可以知道该固体为二氧化锰,由于反应至不再产生气体,说明氯酸钾以完全分解,那么所得溶液为氯化钾溶液,可以知道氯化钾的质量为:100g×7.45%=7.45g;
(1)设氯酸钾的质量为x,生成氧气的质量为y,则:
2KClO3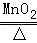 2KCl+3O2↑
2KCl+3O2↑
245 149 96
x 7.45g y
根据: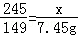 解得:x=12.25g;根据:
解得:x=12.25g;根据: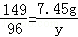 解得y=4.8g
解得y=4.8g
(2)氯酸钾中氯元素的质量为:12.25g×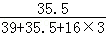 ×100%=3.55g
×100%=3.55g
所以原混合物中氯元素的质 量分数为:
量分数为: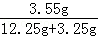 ×100%=22.9%;
×100%=22.9%;
故答案为:
(1)反应放出气体的质量为4.8g;
(2)22.9%
点评: 解答好这类题目,首先,要理解和熟记根据化学反应方 程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.
程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.












