8.(2分)(2013•呼和浩特)海洋资源开发前景广阔.海水晒盐能够得到粗盐和卤水,卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.下列说法不正确的是( )
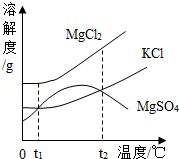
A. t1℃时,三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
B. t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液都可达到饱和
C. t2℃时,KCl和MgSO4两种物质的溶解度相同
D. 将t2℃时的三种物质的饱和溶液降低到t1℃时,均能析出晶体
考点: 固体溶解度曲线及其作用.
专题: 溶液、浊液与溶解度.
分析: 由MgCl2、KCl、MgSO4的溶解度曲线图可知:各物质的溶解度随温度变化的趋势;KCl和MgSO4的溶解度相等的温度有:t1℃、t2℃;将三物质的饱和溶液的温度从t2℃降至t1℃,有晶体析出等信息,并结合饱和溶液中溶质的质量 分数计算式
分数计算式 ×100%进行解答.
×100%进行解答.
解答: 解:A、在t1℃时,三种物质的溶解度中MgCl2的最大,据饱和溶液中溶质的质量分数计算式可知溶解度越大溶质的质量分数越大,所以饱和溶液中,溶质质量分数最大的是MgCl2,说法正确;
B、t1℃时,分别在100g水中溶解了等质量的MgCl2、KCl,两溶液不一定达到饱和,若加入的两物质质量少,则不饱和,故说法错误;
C、由图可知:t2℃时,KCl和MgSO4两种物质的溶解度,说法正确;
D、由图可知;三种物质t2℃时的溶解度均大于t1℃时的溶解度,所以将三物质的饱和溶液的温度从t2℃降至t1℃,都有晶体析出,说法正确;
故选B.
点评: 做好该题的关键是注意图形结合,利用好溶解度和溶解度曲线及二者的关系.以及溶解度随温度的变化规律;了解饱和溶液中溶解度与溶质的质量分数的关系.
9.(2分)(2013•呼和浩特)下列说法正确的是( )
A. 空气中一氧化碳、二氧化硫的增加能导致酸雨
B. 生石灰在空气中变质需要消耗空气中的氧气和水
C. 用适量的水能区分硝酸铵、氯化钠、硫酸铜三种白色固体
D. 电解水时电源正极产生的是能使带火星木条复燃的气体
考点: 酸雨的产生、危害及防治;电解水实验;生石灰的性质与用途;酸、碱、盐的鉴别.
专题: 物质的鉴别题;化学与环境保护;常见的碱 碱的通性.
分析: 导致酸雨形成的物质主要是二氧化硫、氮氧化物等物质;
生石灰在空气中变质,是因为空气中含有水和二氧化碳;
有些物质溶于水时,能够吸热或放热,有些物质溶于水时,颜色会发生变化;
电解水能够生成氢气和氧气.
解答: 解:A、二氧化硫增加到一定程度能够导致酸雨,一氧化碳与酸雨的形成无关.不正确.
B、生石灰在空气中变质的过程为:生石灰吸收水后,能和水反应生成氢氧化钙,所以生石灰在空气中变质需要消耗空气中的水,不消耗氧气.不正确.
C、硝酸铵溶于水时吸收热量,能使溶液温度明显下降;氯化钠溶于水时,溶液的温度几乎不变;硫酸铜溶于水时,溶液的颜色是蓝色的.所以用适量的水能区分硝酸铵、氯化钠、硫酸铜三种白色固体.正确.
D、电解水时,电源正极产生的气体是氧气,电源负极产生的气体是氢气,氧气能使带火星的木条复燃.正确.
故选:CD.
点评: 本题主要考查物质的性质方面的知识,属于考查基础知识,如果掌握了教材内容,正确解答是不成问题的.
10.(2分)(2013•呼和浩特)如图所示a﹣g是初中化学常见的物质.图中“→”表示转化关系,“﹣”表示相互能反应.已知a是人体胃液中含有的酸,g是最轻的气体,b、c、d、e、f都是氧化物.以下说法不正确的是( )
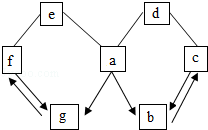
A. g是理想的燃料
B. e与f发生的化学反应类型是化合反应
C. b和c物质中所含元素相同
D. c、d发生反应的化学方程式只能是3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
考点: 物质的鉴别、推断.
专题: 框图型推断题.
分析: a是人体胃液中含有的酸,故a是盐酸,g是最轻的气体,故g是氢气,由此作为推断的出发点,结合题中对b、c、d、e、f都是氧化物的限制条件及图中所示物质A~G是初中化学常见的物质,利用氧化物b物质可由盐酸生成可分析该物质为二氧化碳,把握物质f与g、b与c物质可以相互转化的特点等,完成对框图中所涉及物质的推断.
解答: 解:根据g是最轻的气体,可确定g为氢气;物质f为由氢气反应生成的氧化物且又可生成氢气,可判断f为水;与水和盐酸a都可以反应的氧化物e为可溶性碱所对应的金属氧化物,常见的此类物质为生石灰氧化钙,则可判断物质e为氧化钙,氧化钙与水的反应属于化合反应;能由盐酸生成的氧化物主要为水和二氧化碳,而f物质为水,则b物质为二氧化碳,二氧化碳气体可用于灭火、生产汽水、制纯碱等;能与b物质二氧化碳相互转化的氧化物c应为一氧化碳,根据气体一氧化碳的性质,能与金属氧化物反应氧化还原反应,可判断物质d为常见的金属氧化物,如氧化铁、氧化铜等;一氧化碳在高温条件下与氧化铁反应生成铁和二氧化碳,为工业炼铁的原理反应;
A、由上述分析可知g为氢气,燃烧产物是水,不污染环境,是理想的燃料,故A说法正确;
B、由上述分析可知e为氧化钙,f物质为水,氧化钙和水反应生成氢氧化钙,所以属于化合反应,故B说法正确;
C、由上述分析可知b物质为二氧化碳,c为一氧化碳,都是由碳元素和氧元素组成,故C说法正确;
D、c为一氧化碳,d是金属氧化物,可能是氧化铁,也可能是氧化铜,故D说法错误.
故选D.
点评: 首先找出突破口利用题目明确物质氢气及盐酸,分析得出气体二氧化碳是解决本题物质推断的突破口;熟练掌握物质的性质及转化规律则是此类问题解决的基础.
二、填空题(本题包括5个小题,共14分)
11.(2分)(2013•呼和浩特)化学用语是学习化学的重要工具.请你用化学式表示:
(1)空气成分中可用于填充探空气球的物质是 He ;
(2)用红磷燃烧测定空气中氧气含量时,产生的“大量白烟”是 P2O5 .
考点: 化学式的书写及意义.
专题: 化学用语和质量守恒定律.
分析: 首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
解答: 解:(1)氦气密度小、化学性质很不活泼,可用于填充探空气球,其化学式为:He.
(2)用红磷燃烧测定空气中氧气含量时,红磷燃烧产生的“大量白烟”,白烟是生成的五氧化二磷,其化学式为:P2O5.
故答案为:(1)He;(2)P2O5.
点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.
12.(2分)(2013•呼和浩特)“水是生命之源”,饮用酸碱性太大或硬度太大的水都不利于人体健康.可用 pH试纸 测定水的酸碱度;生活中可通过的 加热煮沸 方法来降低水的硬度.
考点: 溶液的酸碱度测定;硬水与软水.
专题: 空气与水.
分析: 根据溶液酸碱度的测定方法、日常生活软化硬水的方法(煮沸)进行解答进行分析解答.
解答: 解:溶液的酸碱度是指溶液的酸碱性强弱程度,一般用pH来表示,测定水的酸碱度最简单的方法是使用pH试纸.
硬水和软水的区别在于所含的钙镁离子的多少,生活中常用加热煮沸的方法来降低水的硬度.
故答案为:pH试纸;加热煮沸.
点评: 本题难度不大,掌握溶液酸碱度的测定方法(注意和酸碱性区别)、日常生活软化硬水的方法即可正确解答本题.
13.(4分)(2013•呼和浩特)金属与我们的生活息息相关,在各个领域中用途广泛.
(1)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni),伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢.选择铸造硬币的材料不需要考虑的因素是 B (填序号).
A、金属的硬度; B、金属的导电性;
C、金属的耐腐蚀性;D、金属价格与硬币面值的吻合度.
(2)在“南海一号”打捞出来的文物中,“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少.这说明金、铜、铁这三种金属的活动性由强到弱的顺序是 铁>铜>金或Fe>Cu>Au .
(3)高铁酸钠(Na2FeO4)是一种“绿色环保高效”消毒剂.高铁 酸钠中铁元素的化合价为 +6 价.
酸钠中铁元素的化合价为 +6 价.
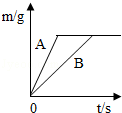
(4)在质量相等、溶质质量分数相同的稀硫酸中,分别加入等质量的锌粉和铁粉,生成氢气质量(m)随反应时间(t)的变化曲线如图所示.下列表述正确的是 ①③⑤ (填序号).
①A表示锌和稀硫酸的反应曲线
②反应结束后消耗两种金属的质量相等
③反应结束后稀硫酸都没有剩余
④反应结束后两种金属一定都有剩余
⑤反应结束后生成的氢气质量相等.
考点: 金属的物理性质及用途;金属的化学性质;金属活动性顺序及其应用;有关元素化合价的计算.
专题: 金属与金属材料.
分析: (1)根据硬币的流通特点分析硬币应具有的特点要求,特别是其耐腐蚀、硬度、及价值的相关因素;
(2)根据金属是否容易生锈考虑本题;
(3)根据在化合物中正负化合价代数和为零考虑;
(4)已知:“等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”:
①锌的活动性比铁的活动性强,等质量的金属,锌反应的时间短;
②由图示可知:生成的氢气的质量相等,所以硫酸均反应完;由方程式分析,二者反应结束后,可能金属都有剩余,也可能锌恰好反应完,铁有剩余;
③由图示可知:生成的氢气的质量相等,所以硫酸均反应完;
④由方程式分析可知:相等质量的铁和锌 与硫酸反应,铁生成氢气多;
与硫酸反应,铁生成氢气多;
⑤因为“等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”,所以反应物的总质量相等;依据质量守恒定律,反应后溶液的质量=反应前的总质量﹣气体的质量﹣不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.
可以根据以上分析进行解答.
解答: 解:(1)根据硬币的流通特点可知:铸造出的硬币要有较强的耐腐蚀性、硬度较大、且硬币价值与面值的吻合度要接近,而金属的导电性不是铸造硬币所考虑的因素;
(2)金属活动性越强,越容易生锈,由“金龙纹手镯”光彩夺目,完好无损;铜镜表面有铜锈;铁器则锈迹斑斑,残存很少,可知铁最活泼,铜次之,金最不活泼.所以,三种金属的活动顺序由强到弱的顺序是 铁>铜>金;
(3)设铁元素化合价为X则:(+1)×2+x+(﹣2)×4=0解得x=+6;
(4)由已知:“等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”进行分析 :
:
①锌的活动性比铁的活动性强,所以等质量的金属,锌反应的时间短,所以A表示锌反应的曲线,故①正确;
②由图示可知:生成的氢气的质量相等,所以硫酸均反应完;Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,由方程式分析可知:如果锌恰好反应,则铁有剩余,所以反应结束后消耗两种金属的质量不相等;故②错误;
③置换反应是金属置换酸中的氢元素,所以若生成的氢气的质量相等,硫酸均反应完;故③正确;
④由图示可知:生成的氢气的质量相等,所以硫酸均反应完;Zn+H2SO4═ZnSO4+H2↑,Fe+H2SO4═FeSO4+H2↑,由方程式分析可知:如果锌恰好反应,则铁有剩余,或者两种金属都有剩余, 故④错误;
故④错误;
⑤由图示可知:生成的氢气的质量相等,故⑤正确.
即①③⑤正确.
故答案为:(1)B;(2)铁>铜>金或Fe>Cu>Au;(3)+6;(4)①③⑤.
点评: 本题结合图象对金属与酸的反应进行了细致的考查,能很好的考查学生对知识的掌握和应用能力,要结合相关知识认真分析.












